Crioscopia
Funzionamento delle piastre eutettiche
Congelamento - Solvente - Soluto - Costante crioscopica - Refrigerazione di container e furgoni
Ogni sostanza pura ha un punto di congelamento ben definito, in condizioni normali.
Ad esempio l'acqua solidifica, alla pressione atmosferica, a 0 °C.
Solvente e soluto nella soluzione eutettica
Se però sciogliamo nell'acqua una certa sostanza, la sua temperatura di solidificazione si abbassa. Tale fenomeno è noto con il nome di crioscopia. Tale abbassamento della temperatura nell'acqua (solvente) dipende dalla quantità e dal tipo di sostanza che viene disciolta (soluto). La relazione matematica che permette di calcolare l'abbassamento della temperatura di congelamento è:
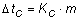
ove Kc è la costante crioscopica e m la molalità del soluto (numero di moli di soluto disciolte in 1 kg di solvente puro). Per calcolare la molalità del soluto basta ricordare che:
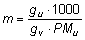
ove gu indica la quantità in grammi del soluto, gv la quantità in grammi del solvente e PMu la massa molecolare del soluto.
Costante crioscopica
Per ogni solvente è possibile determinare una costante crioscopica per via sperimentale.
Infatti, come si evince dalla prima equazione, la costante crioscopica coincide con l'abbassamento della temperatura di congelamento qualora la
molalità del soluto sia unitaria.
Per avere una molalità unitaria, come è possibile ricavare dalla seconda equazione, è sufficiente disciogliere una mole di soluto in
1000 grammi di solvente.
Le piastre eutettiche
Questa proprietà viene utilizzato nel campo della refrigerazione nelle piastre eutettiche, dispositivi in grado di accumulare freddo a temperature anche molto inferiori a 0 °C, grazie ad una soluzione eutettica, generalmente formata da acqua e da un soluto.
Refrigerazione di container e furgoni
Le piastre eutettiche vengono utilizzate nella refrigerazione dei container, dei furgoni per il trasporto dei surgelati e dei gelati ed in tutte quelle situazioni in cui si vuole ottenere una bassa temperatura in piccoli ambienti non dotati di un impianto frigorifero funzionante autonomamente.
Come à fatta una piasra eutettica
Una piastra eutettica è costituita da un serbatoio di forma parallelepipeda entro il quale è posta una serpentina in rame che funge da evaporatore. Il serbatoio è formato da due gusci, generalmente costituiti in lamiera d'acciaio, saldati tra loro.
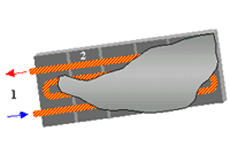
La serpentina è provvista di due attacchi che la possono mettere in comunicazione con un circuito frigorifero esterno (posizione 1).
Lo spazio libero tra il serbatoio e la serpentina è riempito dalla soluzione eutettica (posizione 2).
Generalmente di notte la piastra viene collegata ad un circuito frigorifero in modo che entro la serpentina transiti del refrigerante. In questo modo
la soluzione si solidifica, cedendo così calore latente.
Durante il giorno la piastra viene montata all'interno dell'ambiente da raffreddare, da cui sottrae
calore, il
calore latente di fusione necessario per far sciogliere il composto eutettico.
Temperatura di funzionamento
La temperatura alla quale la soluzione cambia di stato è variabile, a seconda del tipo di soluto e della sua concentrazione.
Una volta determinata la concentrazione del soluto, però, la temperatura di fusione rimane costante durante tutto il tempo in cui si verifica il
cambiamento di stato.
I soluti più usati per ottenere basse temperature di fusione/solidificazione sono il nitrato di sodio e il cloruro di sodio.
Con essi si possono raggiungere temperature di congelamento anche di -35 °C.
 Nell'igloo di Fred trovi anche
Nell'igloo di Fred trovi anche
Il circuito frigorifero
Bilancio energetico in un circuito frigorifero
Evaporazione ed ebollizione
Cambiamenti di stato
Surriscaldamento e potenza frigorifera
Calore ed energia termica
Quanto calore per congelare?
Calore latente e calore sensibile
Calore latente di fusione delle sostanze
Quanto calore per raffreddare?
Calore specifico
Temperatura
Trasporti refrigerati ATP
Bilancio energetico in un circuito frigorifero
Evaporazione ed ebollizione
Cambiamenti di stato
Surriscaldamento e potenza frigorifera
Calore ed energia termica
Quanto calore per congelare?
Calore latente e calore sensibile
Calore latente di fusione delle sostanze
Quanto calore per raffreddare?
Calore specifico
Temperatura
Trasporti refrigerati ATP



